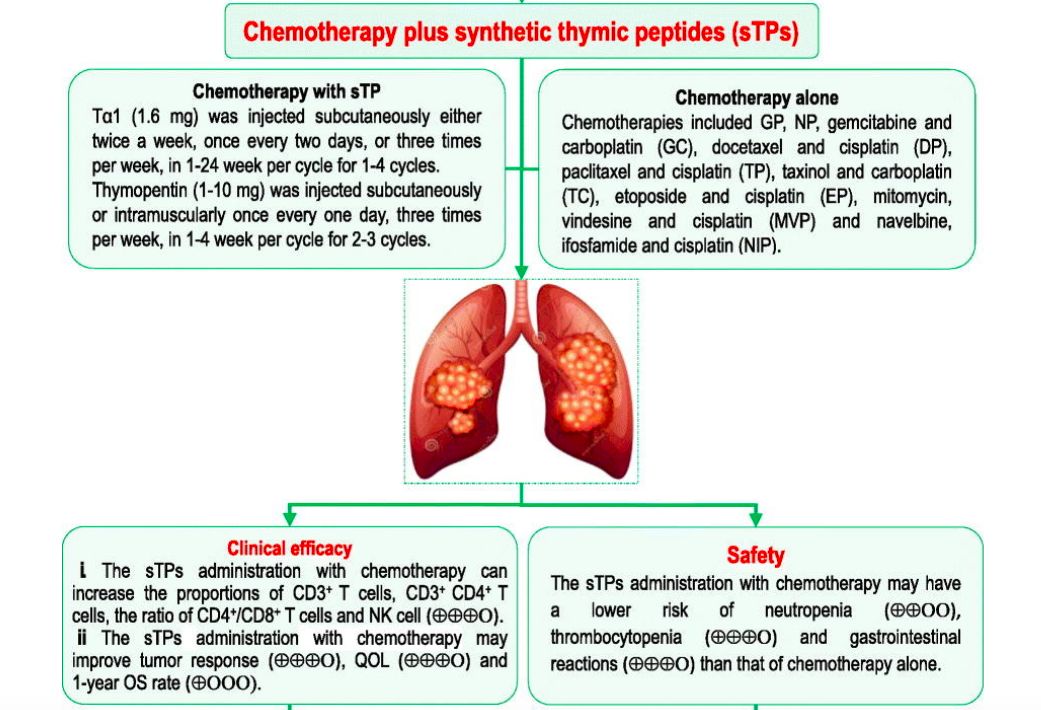
BRAF基因位于染色体7q34,编码丝氨酸/苏氨酸蛋白激酶,是RAF家族成员。BRAF蛋白与KRAS蛋白同为RAS-RAF-MEK-ERK 信号通路中上游调节因子,使MEK蛋白磷酸化,随后的ERK蛋白磷酸化,激活参与细胞增殖和生存的相关基因。突变的BRAF蛋白增强了激酶的活性,可在体外转化。而其中具有致癌以及治疗价值的是V600的突变,主要包括V600E和V600K突变。改为点的突变可引起下游活化致癌,占整体BRAF突变的一半。大多数BRAF突变的患者既往有吸烟史,病理类型是腺癌。BRAF突变与EGFR、KRAS等突变相互独立和排斥,并不同时出现。



BRAF篇概要
基因变异类型
1.Ⅰ类、Ⅱ类、Ⅲ类,BRAFV600E属于Ⅰ类
2. BRF113928研究:达拉菲尼+曲美替尼,经治ORR为63%,初治ORR为61%;双药不能耐受,可选用单药
3. PHAROS研究:Encorafenib+binimetinib,初治ORR为75%、PFS未达到;经治ORR为46%、PFS 9.3个月;双药不能耐受,可选用单药
4. NCT01336634:达拉菲尼,ORR为33%、PFS为5.5个月、OS为12.7个月
5. NCT01524978:维莫非尼,ORR为42%,12个月OS率为66%
耐药机制
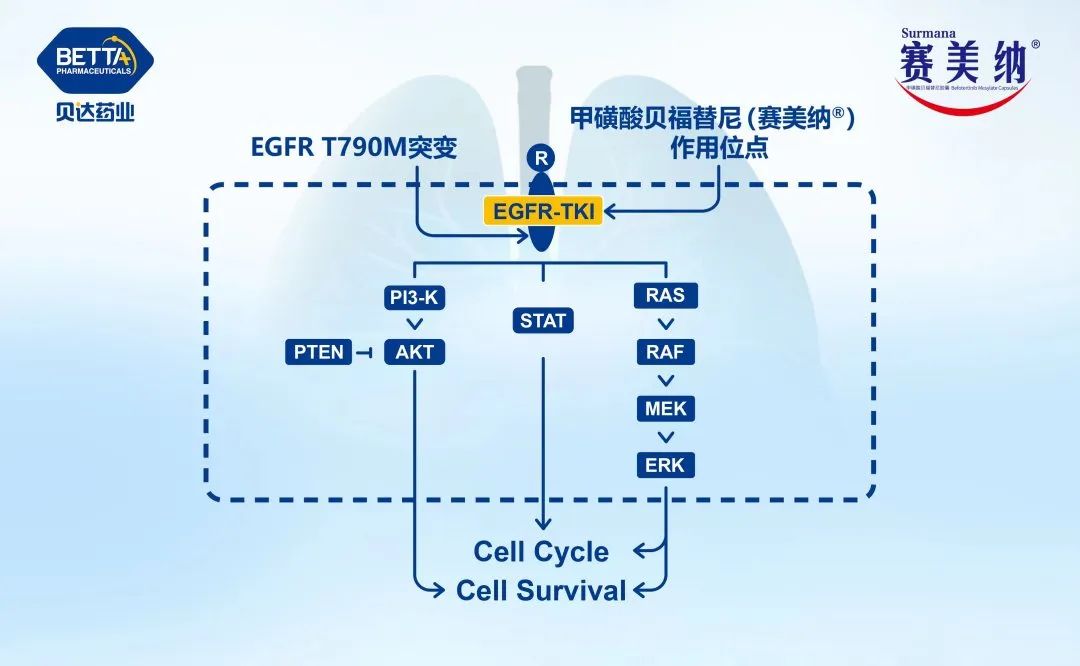
6. PI3K-AKT-mTOR和RAS-RAF-MEK通路的再激活
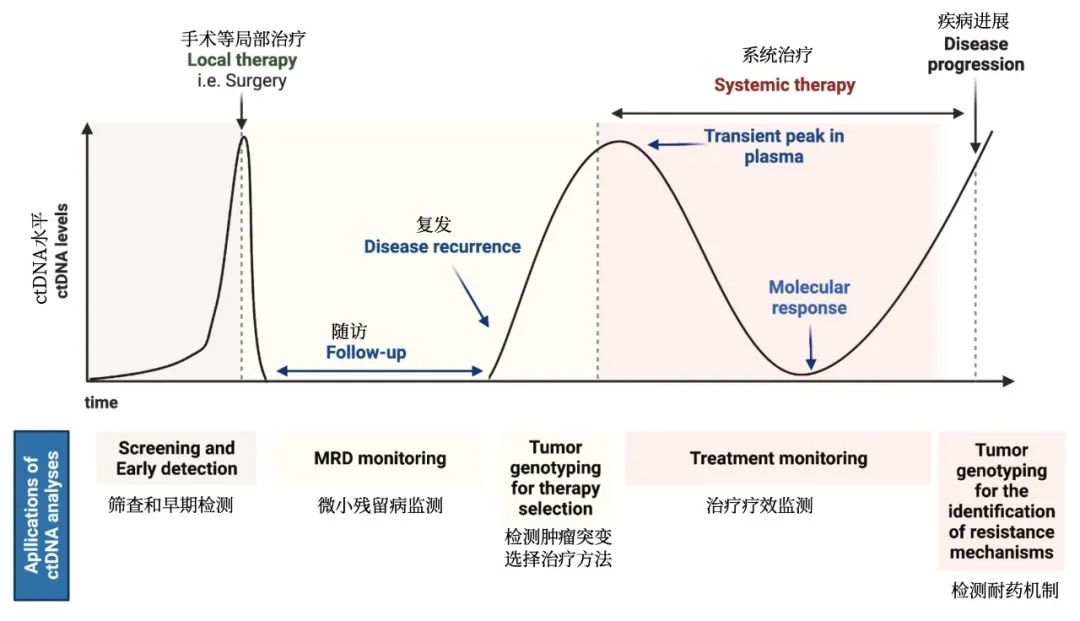
免疫治疗[14]
7. BRAF 突变特别是非 V600E 突变与肿瘤免疫原性高和炎症性微环境相关。多项回顾性研究显示 BRAF 突变患者可从 ICIs 治疗中获益。
NSCLC BRAF突变谱[1]
II类BRAF基因改变对BRAF二聚体抑制剂(Lifirafenib,LY3009120和LXH254)或MEK抑制剂或二者联合方案敏感。
NSCLC中BRAF激酶区复制(BRAF KDD)和BRAF融合罕见,不到0.5%;BRAF突变约1-4%,主要为V600E突变。
BRAF激酶区复制(BRAF-KDD)在晚期肿瘤患者中发生比例0.11%。而BRAF融合(BRAF Fusion)更为罕见,在1万多名晚期肿瘤患者中仅检出39例,其中黑色素瘤中1.71%,非小细胞肺癌(均为腺癌)中0.38%,甲状腺癌中1.33%,结直肠癌中0.20%。
2019AACR首次报道中国人群中肺癌BRAF KDD比例为0.03%(2/6837),2018ASCO首次报道中国人群NSCLC中BRAF融合的比例为0.04%(1/2410)。文献报道肺癌中融合类型有AGK-BRAF,PJA2-BRAF,SND1-BRAF,MRPS33-BRAF,PARP12-BRAF,TRIM24-BRAF,BRAF-BRAF,、DOCK4-BRAF,ARMC10-BRAF,UBN2-BRAF,NUP214-BRAF,TRIO-BRAF,PARP12-BRAF,TRIM4-BRAF,PTPN13-BRAF,LMO7-BRAF,ZC3HAV1-BRAF,EPS15-BRAF,PTPN2-BRAF,BIN1-BRAF,BTF3L4-BRAF,GHR-BRAF,SND1-BRAF,MKRN1-BRAF,GRM8-BRAF,KCND2-BRAF,EYS-BRAF,AP3B1-BRAF,SMOX-BRAF,CUX1-BRAF,PCBP2-BRAF和BAIAP2L1-BRAF。

BRAF基因改变分类[2]
靶向治疗



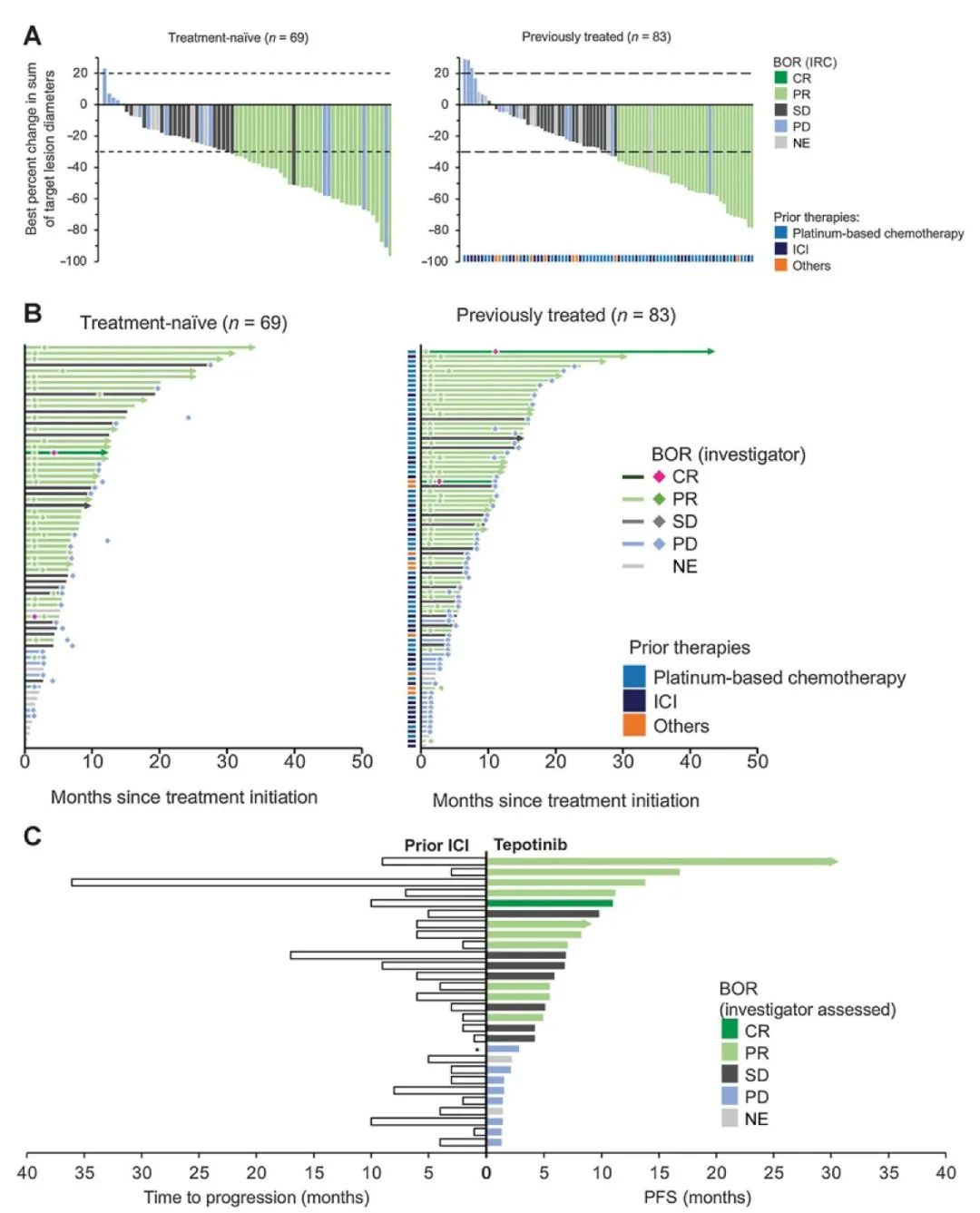
经治患者瀑布图

初治患者瀑布图

常见不良反应

常见实验室检查异常


↑ 临床疗效
← 基线特征


Encorafenib+binimetinib与达拉非尼+曲美替尼的不良反应类型有较大差异,达拉非尼+曲美替尼最常见的不良反应为发热(56%),恶心(51%)和呕吐(41%),而Encorafenib+binimetinib为恶心(50%),腹泻(43%)和疲倦(32%)。


经治患者瀑布、游泳图


NSCLC瀑布图
一项以色列Rabin医学中心Dudnik等的报告[11],携带BRAF突变的非小细胞肺癌(NSCLC)与PD-L1高表达水平、低至中等肿瘤基因突变负荷(TMB)和微卫星稳定状态相关。免疫检查点抑制剂(ICPi)在BRAF V600E突变型和BRAF非V600E突变型NSCLC患者中均有良好的表现。
ICPi治疗BRAF基因突变NSCLC的疗效未知。该项多机构回顾性研究分析了39例BRAF基因突变NSCLC患者,V600E突变患者21例,非V600E突变患者18例,分别在29例、11例和12例患者中检测了PD-L1表达、TMB和微卫星不稳定性(MSI)。
结果显示,V600E突变患者中,PD-L1高表达(≥50%)、中表达(1%-49%)和不表达(<1%)比例分别为42%、32%和26%,在非V600E突变患者中分别为50%、10%和40%。V600E突变患者中有2例为高TMB患者,没有高MSI患者。
与未接受ICIs治疗的患者(n=17)比较,接受ICIs治疗的BRAF突变患者(22例,其中41%为ICIs一线治疗,其余为后线治疗)OS获益显著(中位OS分别为未达到和21.1个月,P=0.018)。
另外,V600E突变(n=12例)和非V600E突变(n=10)患者接受了ICPi治疗,客观缓解率分别为25%和33%(p=1.0),中位PFS分别为3.7个月和4.1个月(p=0.37),中位OS均未达到(p=0.53)。
IMMUNOTARGET研究是一项全球多中心ICIs单药治疗突变型NSCLC的真实世界研究[12],研究纳入551例各类突变肺癌患者,其中85%的患者接受nivolumab治疗,中位治疗线数为二线。该研究共收集BRAF突变患者43例, ORR为24.3%,DCR为54%,中位PFS为3.1个月,中位OS为13.6个月,其中亚组分析提示吸烟的BRAF突变患者PFS获益更大(中位PFS:无吸烟史 vs 有吸烟史为1.9个月 vs 4.1个月,P=0.03)。另外,V600E突变(n=17)和非V600E突变患者(n=18)的中位PFS分别为1.8和4.1个月(P=0.2),中位0S分别为8.2和17.2个月(P=0.28)。
IMAD2(GFPC 01-2018)研究是由法国肺癌组织(GFPC)开展的回顾性多中心研究[13],旨在评估BRAF、HER2、MET突变或RET重排晚期NSCLC接受免疫治疗的疗效。研究共纳入来自法国21个中心的107例患者,BRAF队列纳入了44例接受ICIs治疗的BRAF突变患者(V600E突变患者26例),其中91%的患者接受ICIs治疗前已经接受过其他方案治疗,结果显示,BRAFV600E和BRAF非V600E突变患者接受ICIs治疗的ORR分别为26%和35%,中位PFS分别为5.3和4.9个月,1年生存率分别为53.4%和44.0%。
参考文献
[1]Dagogo-Jack I. Durable Response to Dabrafenib Combined With Trametinib in a Patient With NSCLC Harboring a BRAF G469A Mutation. J Thorac Oncol. 2020 Oct;15(10):e174-e176. doi: 10.1016/j.jtho.2020.07.007.
[2]Yaeger R, Corcoran RB. Targeting Alterations in the RAF-MEK Pathway. Cancer Discov. 2019 Mar;9(3):329-341. doi: 10.1158/2159-8290.CD-18-1321.
[3]Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017 Oct;18(10):1307-1316. doi: 10.1016/S1470-2045(17)30679-4.
[4]Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016 Jul;17(7):984-993. doi: 10.1016/S1470-2045(16)30146-2.
[5]Odogwu L, Mathieu L, Blumenthal G,et al. FDA Approval Summary: Dabrafenib and Trametinib for the Treatment of Metastatic Non-Small Cell Lung Cancers Harboring BRAF V600E Mutations. Oncologist. 2018 Jun;23(6):740-745. doi: 10.1634/theoncologist.2017-0642.
[6]FDA达拉非尼说明书
[7]Riely GJ, Smit EF, Ahn MJ, et al. Phase II, Open-Label Study of Encorafenib Plus Binimetinib in Patients With BRAFV600-Mutant Metastatic Non-Small-Cell Lung Cancer. J Clin Oncol. 2023 Jul 20;41(21):3700-3711. doi: 10.1200/JCO.23.00774.
[8]Planchard D, Kim TM, Mazieres J, et al. Dabrafenib in patients with BRAF(V600E)-positive advanced non-small-cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol. 2016 May;17(5):642-50. doi: 10.1016/S1470-2045(16)00077-2.
[9]Hyman DM, Puzanov I, Subbiah V, et al. Vemurafenib in Multiple Nonmelanoma Cancers with BRAF V600 Mutations. N Engl J Med. 2015 Aug 20;373(8):726-36. doi: 10.1056/NEJMoa1502309.
[10]Negrao MV, Skoulidis F, Montesion M, et al. Oncogene-specific differences in tumor mutational burden, PD-L1 expression, and outcomes from immunotherapy in non-small cell lung cancer. J Immunother Cancer. 2021 Aug;9(8):e002891. doi: 10.1136/jitc-2021-002891.
[11]Dudnik E, Peled N, Nechushtan H, et al. BRAF Mutant Lung Cancer: Programmed Death Ligand 1 Expression, Tumor Mutational Burden, Microsatellite Instability Status, and Response to Immune Check-Point Inhibitors. J Thorac Oncol. 2018 Aug;13(8):1128-1137. doi: 10.1016/j.jtho.2018.04.024.
[12]Mazieres J, Drilon A, Lusque A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry[J]. Ann Oncol,2019,30(8):1321-1328. DOl:10.1093/annonc/mdz167.
[13]Guisier F, Dubos-Arvis C, Vinas F, et al. Efficacy and safety ofanti-PD-1 immunotherapy in patients with advanced NSCLC with BRAF, HER2, or MET mutations or RET translocation: GFPC01-2018[J]. JThorac Oncol,2020,15(4):628-636. DOI:10.1016/j. jtho.2019.12.129.
[14]中国抗癌协会肿瘤精准治疗专业委员会, 中华医学会杂志社肺癌研究协作组. 晚期驱动基因阳性非小细胞肺癌免疫治疗专家共识(2022版)[J]. 中华肿瘤杂志, 2022, 44(10):1047-1065.DOI: 10.3760/cma.j.cn112152-20220614-00416